-
大肠癌(colorectal cancers,CRC)的发病率及死亡率在我国呈逐年升高趋势,严重危害人类健康[1]。由于大肠癌早期的临床症状不典型,早筛的普及性较差,大部分患者就诊时已经是中晚期,丧失了手术机会,所以化疗仍然是大肠癌的主要治疗手段之一。目前针对大肠癌的标准化疗方案是以氟尿嘧啶为基础的联合方案[2],但由于错配修复基因缺失(deficient mismatch repair,dMMR),导致肠癌患者天然对氟尿嘧啶药物不敏感[3-4],以致患者不能从治疗中获益。以往研究显示中药土家蜚蠊对大肠癌具有抗肿瘤作用[5]。本研究将蜚蠊与氟尿嘧啶(5-FU)联合作用于dMMR肠癌细胞,探究蜚蠊联合氟尿嘧啶对dMMR大肠癌细胞的增效作用,并应用脂质组学技术挖掘相关通路及机制,以期为临床提高dMMR大肠癌患者的疗效提供有效策略。
-
1 材料与方法
-
1.1 实验材料
-
1.1.1 细胞
-
人源大肠癌HCT116、DLD1细胞株购自美国ATCC细胞库,由四川大学生物治疗国重实验室冻存保管,前期研究证实HCT116为MLH1基因缺失细胞,DLD1为MSH6基因缺失细胞,均为dMMR大肠癌细胞[6]。
-
1.1.2 药物
-
蜚蠊脱脂精粉(生产批号:202040328-02)购于弥渡县云峰美蠊养殖基地。蜚蠊含药血清制备:1)SPF级SD大鼠,随机分为2组,空白对照组(NC)和蜚蠊含药血清组(FL),蜚蠊组按成人临床等效剂量(15 g/60 kg)的10倍来配制蜚蠊混悬液,药物浓度为0.25 g/mL,按10 mL/kg灌胃给药,空白对照组以等剂量生理盐水灌胃,1次/d,连续饲养7 d。2)大鼠末次灌胃1 h后,采集腹主动脉血,留取血清,分装保存至-20℃冰箱。
-
1.2 实验方法
-
1.2.1 MTT法检测蜚蠊对HCT116、DLD1肠癌细胞增殖抑制作用
-
将100 µL配制好的蜚蠊加入96孔板中,每孔按总体积的1.5%、3%、6%、12%、24%比例加入,5-FU配置成0.6、1.25、2.5、5、10 μmol/L不同剂量,加入96孔板中,FL+5-FU根据上述剂量联合作用于细胞,每组剂量重复3次,作用24 h、48 h和72 h后进行MTT测定,抑制率=[1-(实验孔OD值-空白组OD值)/(对照孔OD值-空白组OD值)]×100%。
-
1.2.2 通过Calcusyn2.0计算两药联合治疗指数(CI值)
-
药物联合治疗目的是达到协同增效。联合治疗指数CI是量化协同作用简单的方法。本研究依据Calcusyn软件的Chou and Talalay[7]方法,分析用不同浓度蜚蠊和5-FU药物组合联合共同处理48 h结直肠癌细胞的细胞毒性。CI<0.75为协同作用,0.75~1.25为叠加作用,CI>1.25为拮抗作用。
-
1.2.3 基因本体论(gene ontology,GO)功能富集分析
-
GO分析的主要作用就是对差异表达的基因进行基因功能注释分析,通过OmicShare云平台进入GO数据库,上传二代测序获得蜚蠊联合5-FU与5-FU单药间差异基因,用DAVID数据库(https://david.ncifcrf.gov/tools.jsp),对差异基因的功能进行注释分析,寻找两组之间差异通路。
-
1.2.4 高效液相色谱质谱串联仪(LC/MS)进行脂质检测
-
药物作用72 h后对细胞进行脂相提取,Acquity UPLC系统进样分析[8],利用Q-TOF质谱(waters,manchester,U.K.)进行全脂质组学的测定。在数据库Lipid Maps Database和Human Metabolome Database中,利用m/z鉴定代谢物,最后将数据导入Progenesis QI(newcastle,UK1)进行校准。对代谢物进行非成对模式t检验,筛选出有统计学差异的代谢物(P<0.05)。
-
1.3 统计学分析
-
所有数据采用SPSS 19.0和Graphpad prism 7.0软件进行分析及作图,组间率的比较采取ANOVA方法进行检验。HCT116细胞MTT数据,检验方差不齐,采用K-W非参数检验。以P<0.05为差异有统计学意义。
-
2 结果
-
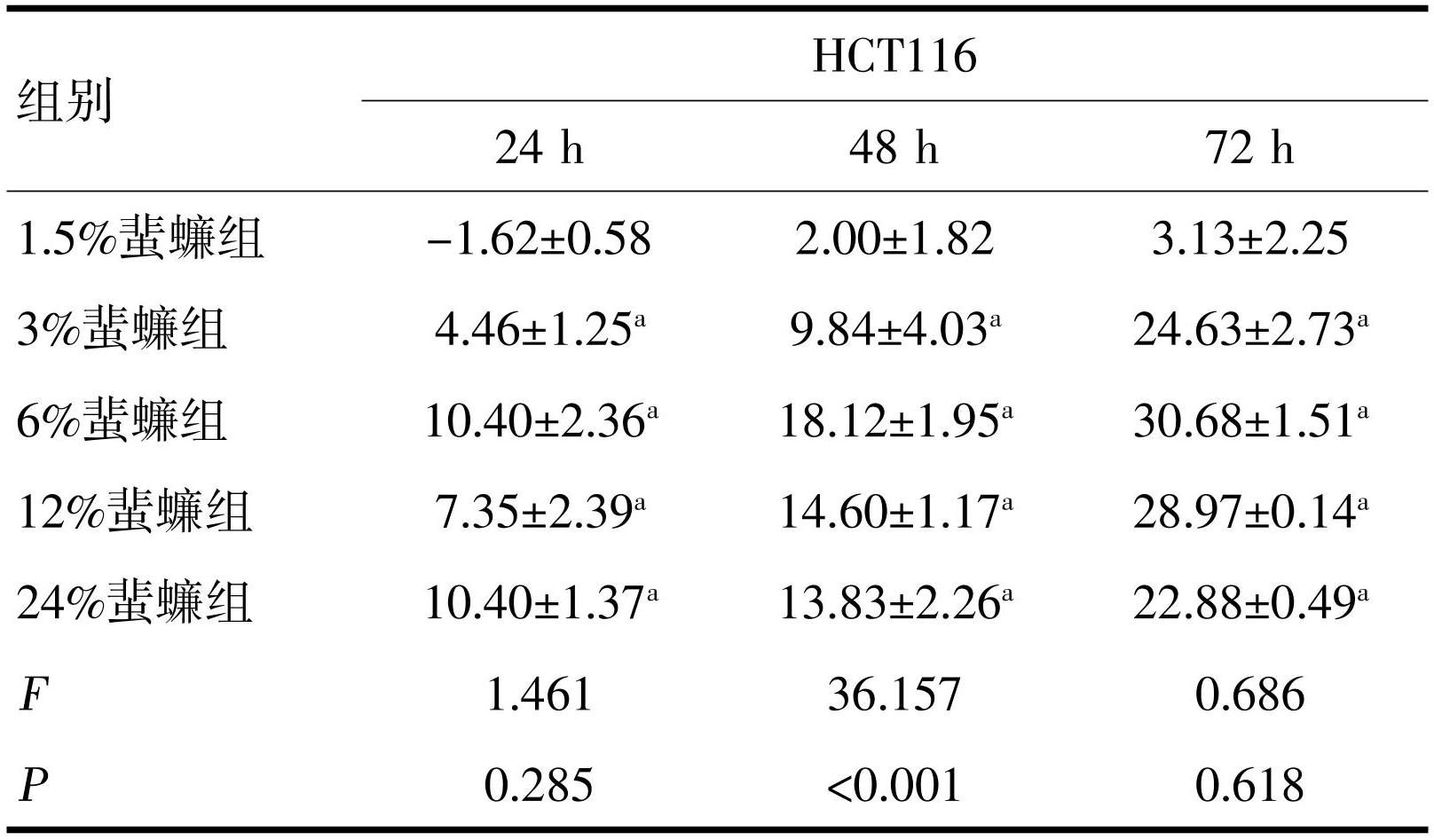
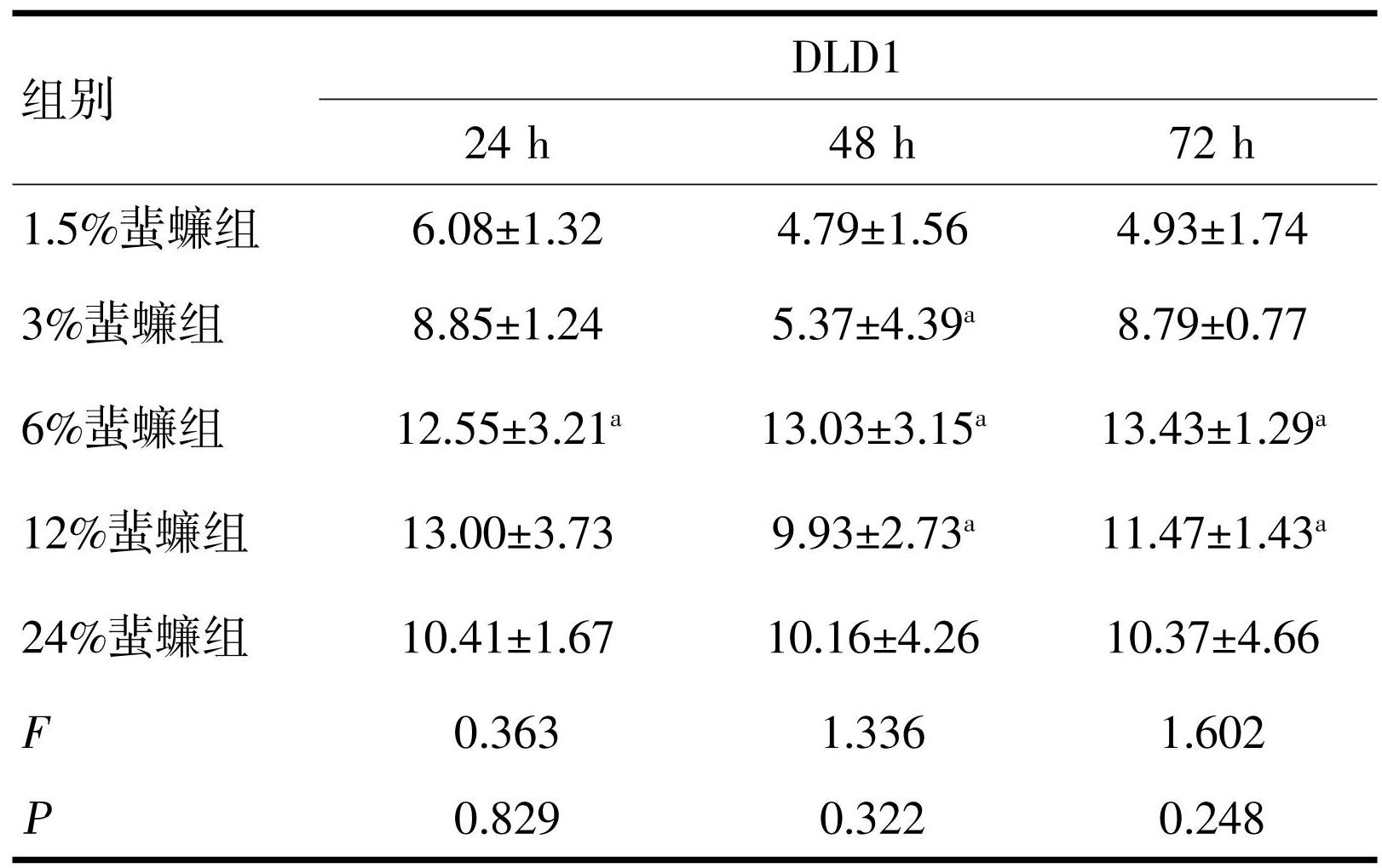
2.1 蜚蠊含药血清对大肠癌细胞增殖的抑制作用
-
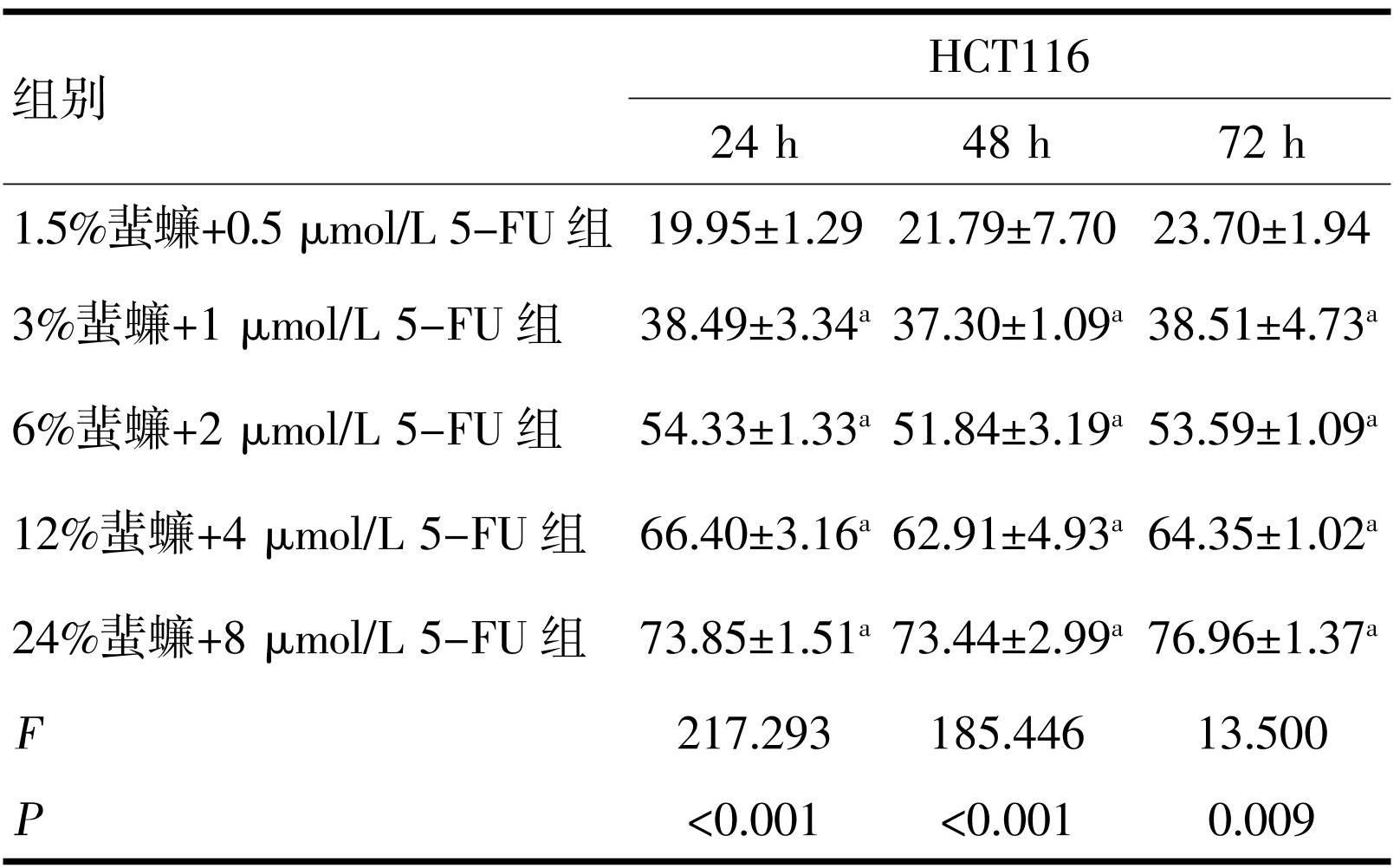
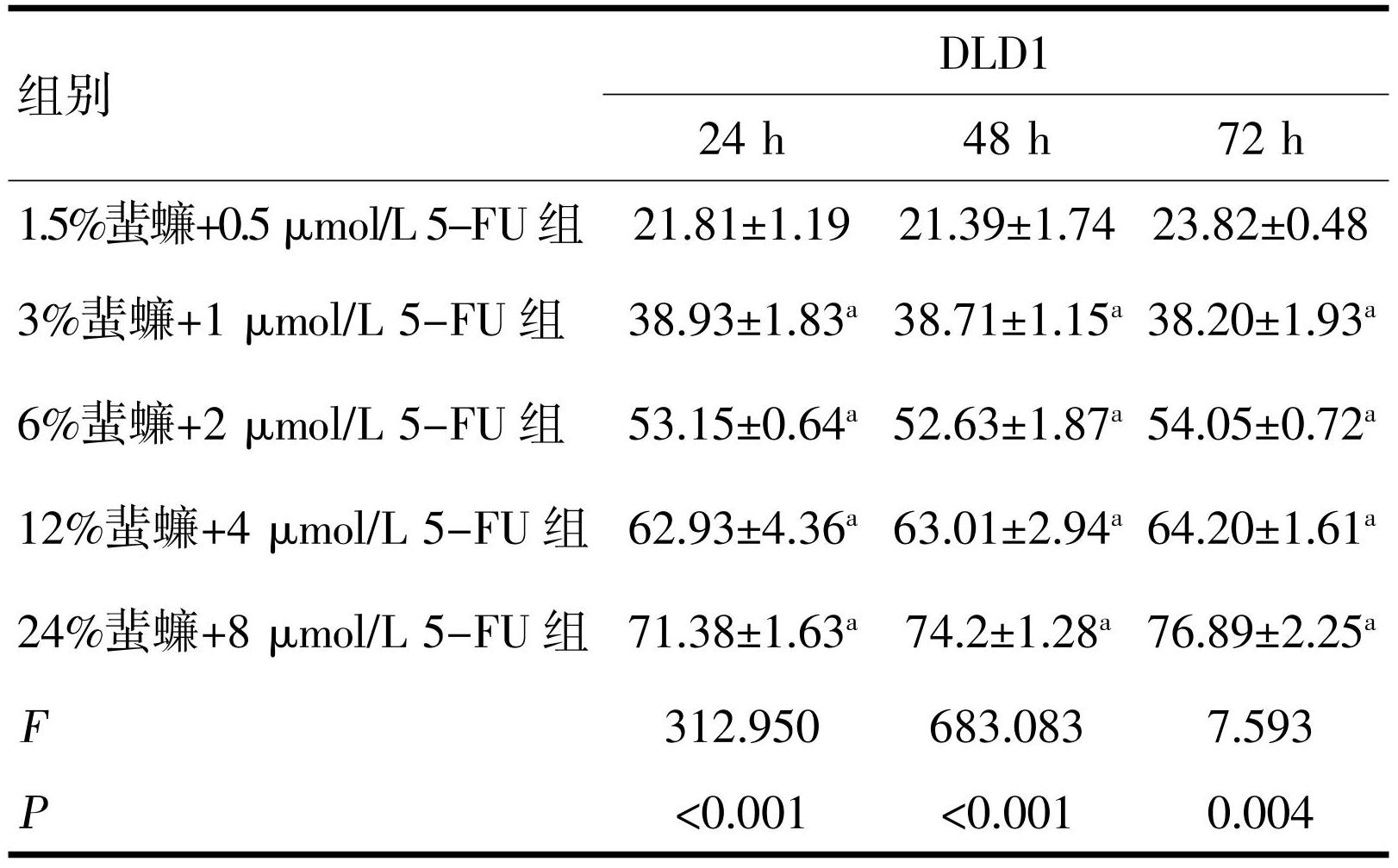
MTT实验结果显示,不同蜚蠊浓度对HCT116和DLD1细胞均显示出抑制作用,但抑制率不随浓度加大而升高,统计学无意义。蜚蠊浓度为6%时对HCT116和DLD1细胞抑制作用较为明显。蜚蠊与5-FU联合作用HCT116和DLD1细胞后显示出较好的抑制作用,且随5-FU浓度增加抑制率越好,差异均有统计学意义(P<0.05,表1~4)。
-
注:a与1.5%蜚蠊组比较,P<0.05
-
注:a与1.5%蜚蠊+0.5 μmol/L 5-FU组比较,P<0.05
-
注:a与1.5%蜚蠊组比较,P<0.05
-
注:a与1.5%蜚蠊+0.5 μmol/L 5-FU组比较,P<0.05
-
2.2 蜚蠊联合5-FU对结直肠癌细胞的联合治疗指数(CI)值检测
-
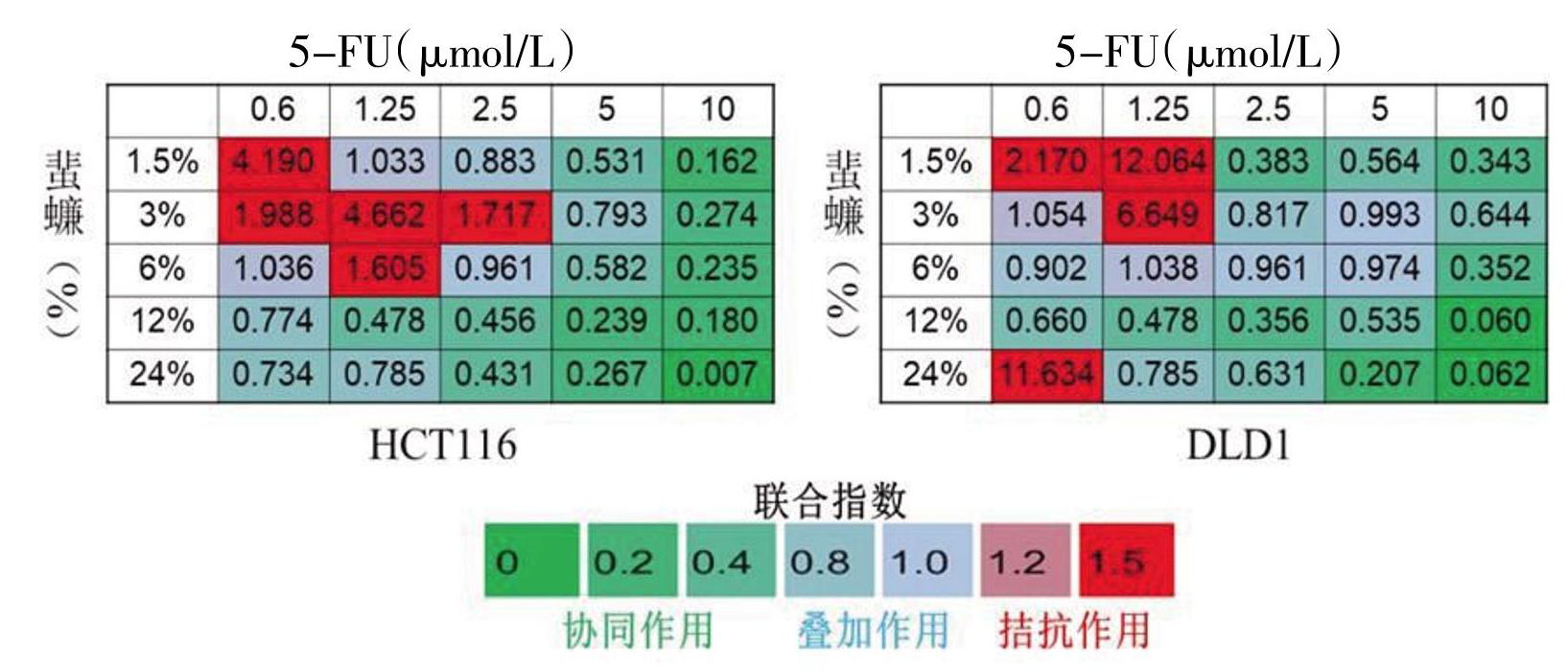
给予上述同剂量的蜚蠊与不同剂量5-FU联合作用HCT116和DLD1细胞后,在HCT116细胞中,蜚蠊浓度在6%时与5-FU 10 μmol/L组合的CI指数为0.24。在DLD1细胞中,相同剂量组合两药CI指数为0.35,CI指数明显低于0.75,表明当蜚蠊浓度在6%时与5-FU 10 μmol/L结合时,协同抗增殖作用最强,见图1。所以本研究选择HCT116细胞进行后续实验研究。
-
图1 蜚蠊与5-FU联合用药后在HCT116、DLD1大肠癌细胞中CI值
-
2.3 基因测序检测两药联合后差异基因及KEGG富集分析
-
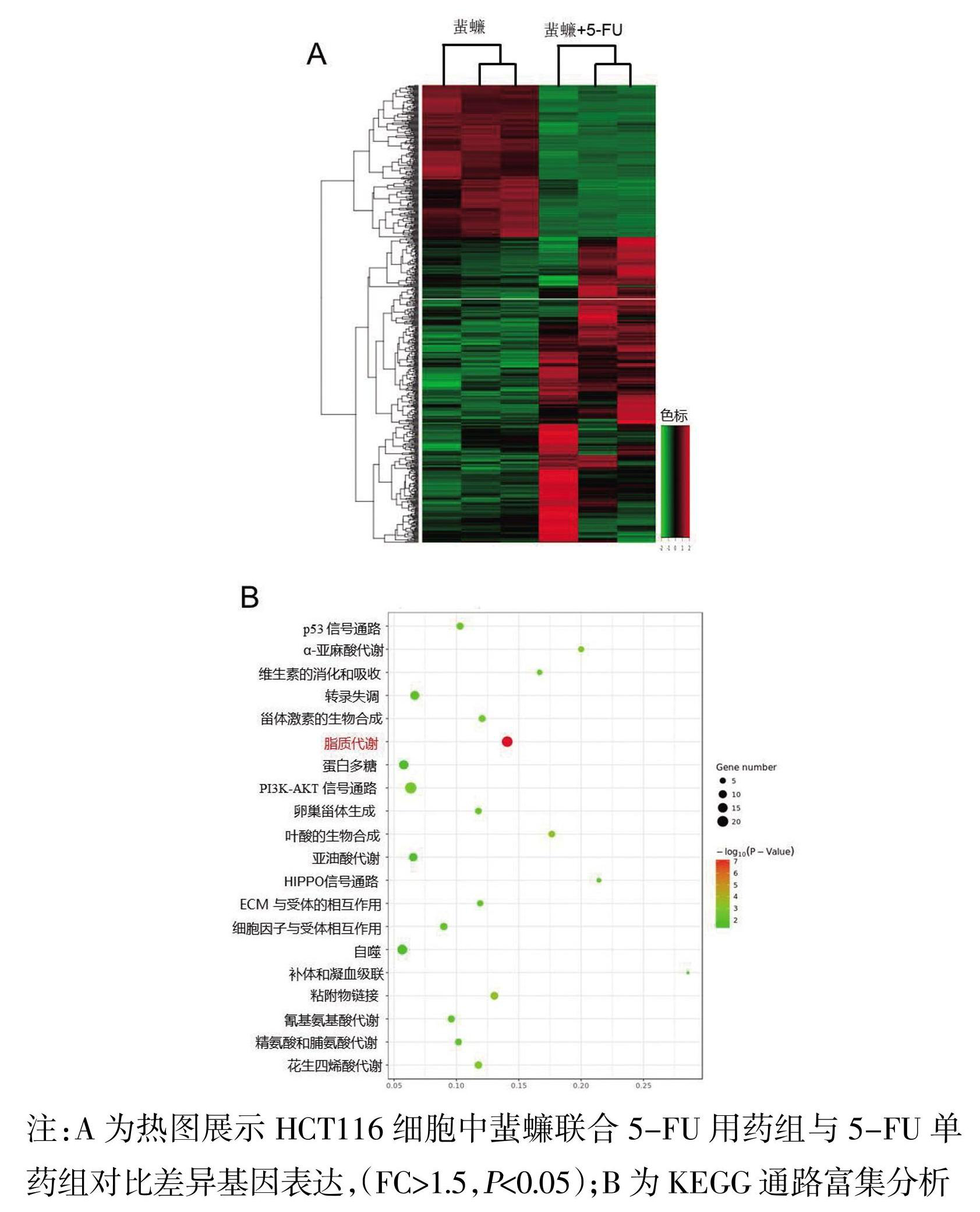
基因测序发现两药联合与5-FU单药之间有3276个基因发生显著变化(FC>1.5,FDR<0.05),通过京都基因和基因组数据库(Kyoto Encyclopedia of Genes and Genomes,KEGG)分析显示,最重要的富集通路在脂质代谢、自噬、黏附物连接和PI3K-AKT-mTOR等通路(图2)。
-
图2 蜚蠊与5-FU联合用药后在HCT116细胞中差异基因及通路变化
-
2.4 GO功能分析
-
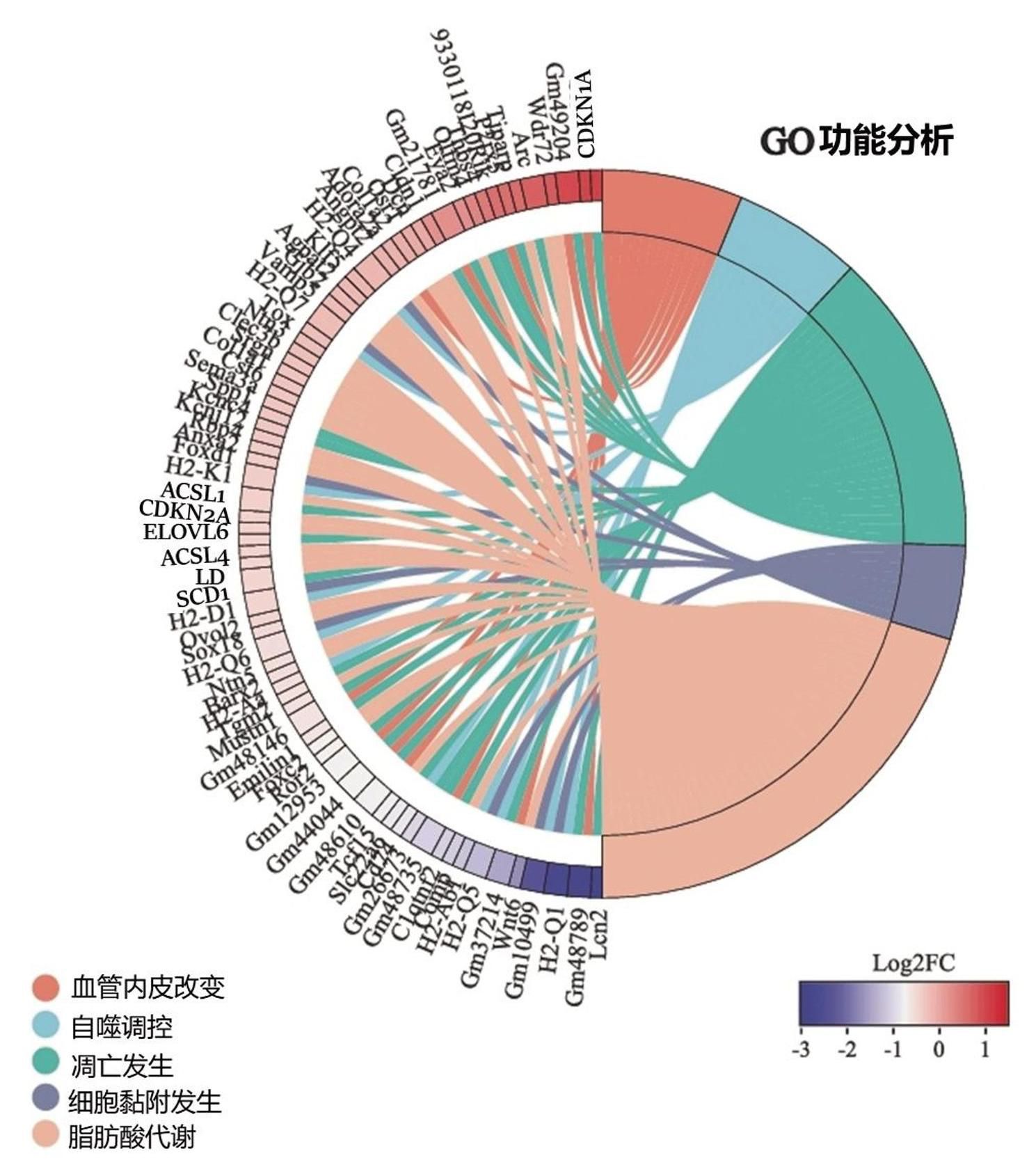
GO功能分析发现主要生物过程包括脂肪酸代谢、血管内皮改变、自噬调控、凋亡发生及细胞黏附等生物学过程发生主要改变(图3)。对通路中显著差异变化基因进行挖掘,脂肪酸代谢发现脂滴(LD)、去饱和酶1(SCD1)、Acyl-CoA合成酶1(ACSL1)、Acyl-CoA合成酶(ACSL4)、ELOVL6、ACAT1基因发生显著改变。凋亡通路中CDKN1A、CDKN2A和FASLG基因变化显著(图3)。
-
图3 GO功能分析HCT116细胞中蜚蠊联合5-FU用药组与5-FU单药组主要生物学改变中基因情况
-
2.5 脂质组学检测
-
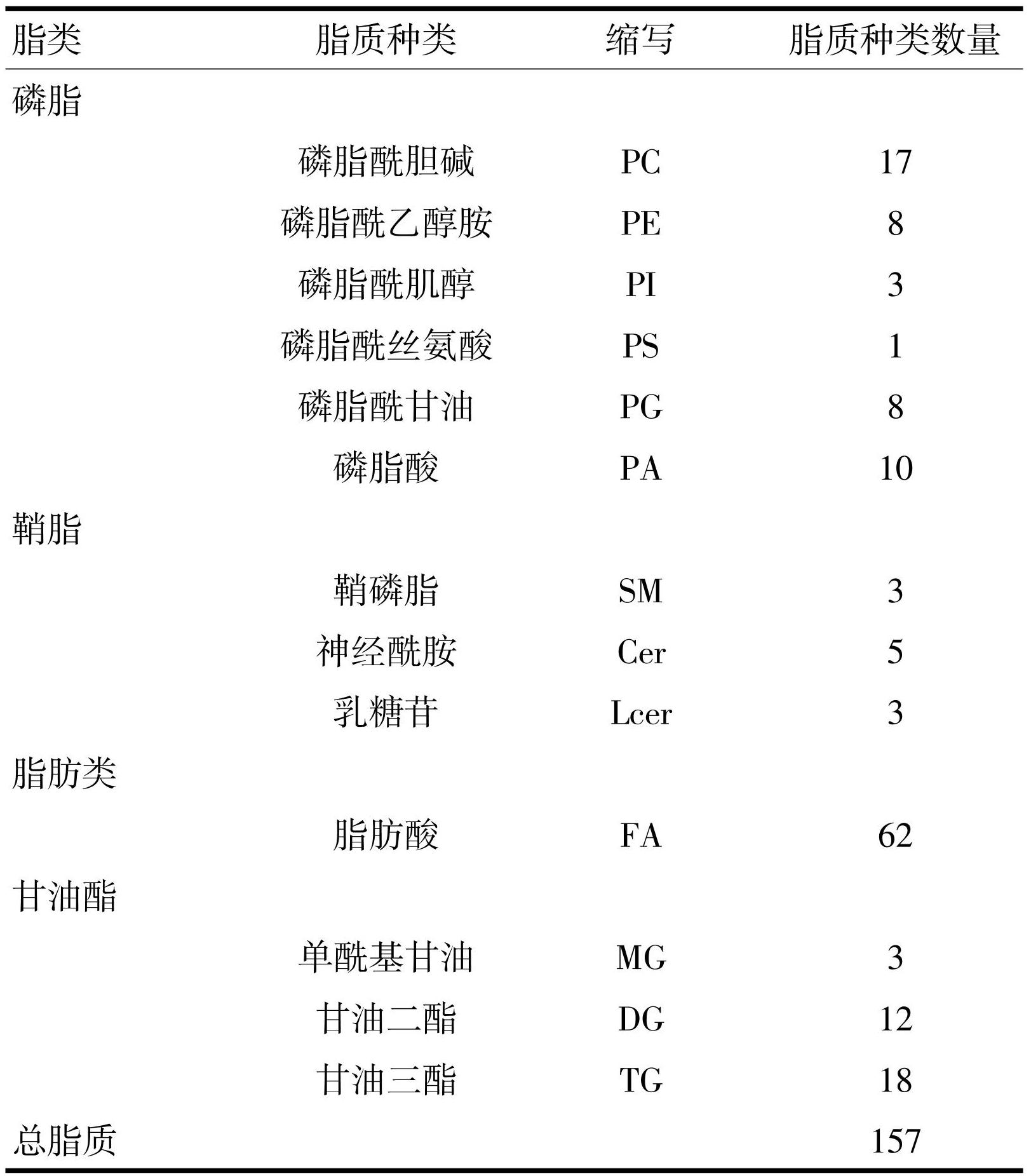
蜚蠊联合5-FU处理HCT116细胞后,对脂质组学检测出的差异代谢物进行鉴定,鉴定出153个脂质分子,包括脂肪类(62个分子)、鞘脂代谢物(11个分子)、磷脂代谢物(47个分子)和甘油酯(33个分子),见表5。
-
3 讨论
-
虽然已有越来越多的治疗方法应用于大肠癌患者,但由于大肠癌属于“冷肿瘤”,免疫治疗疗效欠佳,靶向药物需要与化疗药物联合应用才能发挥较大的抗肿瘤作用,所以化疗仍然是大肠癌患者主要治疗手段之一。5-FU为结直肠癌患者化疗的基石用药,应用于术后辅助治疗及晚期患者多线治疗。但dMMR肠癌患者对5-FU“天然耐药”或抵抗不能获益影响了患者预后,因此,如何提高5-FU在dMMR肠癌患者的疗效是亟待解决的重要问题。有研究发现,美洲大蠊提取物对食管癌、胃癌细胞均有抑制作用[9],并且可以逆转人肝癌细胞的多药耐药性[10-12]。在本研究中,我们应用中西医结合治疗理念,应用土家药蜚蠊与5-FU联合用于dMMR大肠癌细胞,探讨中药蜚蠊改善5-FU在dMMR肠癌细胞中疗效的相关性,发现脂质代谢、自噬和凋亡等生物信号发生主要改变,两药联合可能通过脂质代谢途径逆转耐药,从而达到协同增效作用。
-
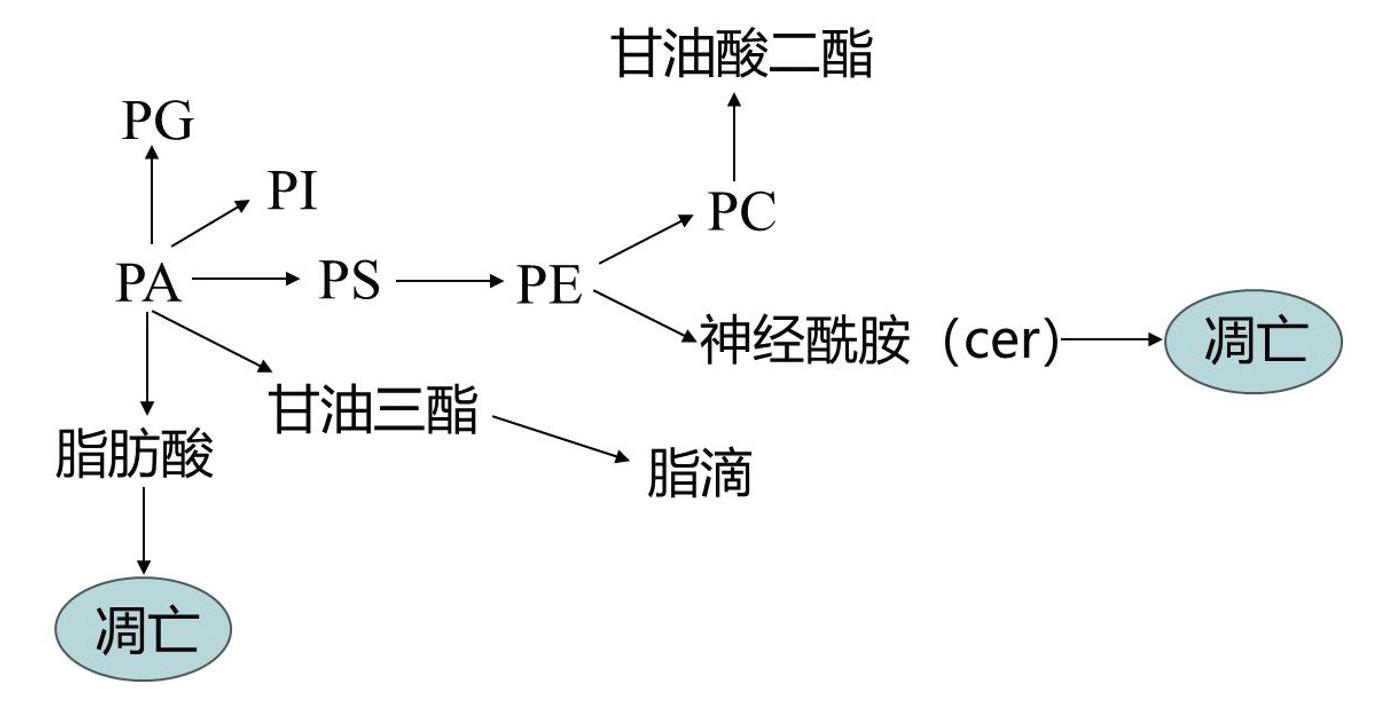
本研究发现,脂质代谢在两药协同增效上发挥重要作用,应用LC/MS技术进行脂质组学检测到磷脂和甘油酯代谢异常。膜磷脂(包括PC、PE、PI、PA和Cer)是调节细胞增殖和耐药的重要信号分子,磷脂的代谢改变有助于肿瘤的进展和耐药[13]。其中ACSL是调节脂质代谢的关键酶,包括脂肪酸伸长、氧化分解、磷脂生成和蛋白质酰化,与转移和不良生存预后相关[14],脂滴(LD)由脂质核心(甘油酯和甾醇酯)组成,研究证实抑制LD的积累可以改善5-FU疗效[15-16]。SCD1是生成复合脂质如磷脂,甘油三酯和胆固醇酯关键基质。敲除SCD1可以抑制肿瘤细胞的侵袭性,使肿瘤患者对各种治疗更敏感[17-18]。同时,本研究发现凋亡通路发生显著改变,FASLG基因是肿瘤坏死因子家族成员,CDKN1A、CDKN2A在凋亡执行过程中发挥重要作用。磷脂代谢异常引起脂肪酸及神经酰胺代谢异常诱导凋亡的发生(图4)。因此,蜚蠊改善5-FU疗效可能是通过脂质代谢改变诱导细胞凋亡达到协同增效作用。
-
图4 脂质代谢通路示意图
-
综上所述,中药美洲蜚蠊作用于dMMR肠癌细胞可以改善5-FU的敏感性,可能与肿瘤细胞脂质代谢改变诱导凋亡发生有关。本研究利用现代医学研究手段为中药蜚蠊的抗肿瘤作用及联合西药抗肿瘤研究提供了一定的理论基础。但仍然需要从更深层次的分子及基因水平探究其作用机制,将中西医结合更好地应用于临床。
-
参考文献
-
[1] Siegel RL,Miller KD,Jemal A.Cancer statistics,2020[J].CA Cancer J Clin,2020,70(1):7-30.
-
[2] Zhang Y,Talmon G,Wang J.MicroRNA-587 antagonizes 5-FU-induced apoptosis and confers drug resistance by regulating PPP2R1B expression in colorectal cancer[J].Cell Death Dis,2015,6(8):e1845.
-
[3] Lizardo DY,Kuang CY,Hao SS,et al.Immunotherapy efficacy on mismatch repair-deficient colorectal cancer:from bench to bedside[J].Biochim Biophys Acta Rev Cancer,2020,1874(2):188447.
-
[4] Jover R,Zapater P,Castells A,et al.Mismatch repair status in the prediction of benefit from adjuvant fluorouracil chemotherapy in colorectal cancer[J].Gut,2006,55(6):848-855.
-
[5] 唐东昕,杨柱,龙奉玺.土家药东方蠊对小鼠结肠腺癌的抑制作用[J].贵阳中医学院学报,2013,35(6):28-30.
-
[6] Peng W,Tan SS,Xu YZ,et al.LC-MS/MS metabolome analysis detects the changes in the lipid metabolic profiles of dMMR and pMMR cells[J].Oncol Rep,2018,40(2):1026-1034.
-
[7] Chou TC.Drug combination studies and their synergy quantification using the Chou-Talalay method[J].Cancer Res,2010,70(2):440-446.
-
[8] Sarafian MH,Gaudin M,Lewis MR,et al.Objective set of criteria for optimization of sample preparation procedures for ultra-high throughput untargeted blood plasma lipid profiling by ultra performance liquid chromatography-mass spectrometry[J].Anal Chem,2014,86(12):5766-5774.
-
[9] 高洁,朱娟娟,刘瑾华,等.美洲大蠊提取物促组织修复作用机制研究进展[J].四川动物,2019,38(2):235-240.
-
[10] 李彩琳,吕鸿,张鸿翰,等.美洲大蠊多肽逆转人肝癌HepG2/ADM细胞多药耐药性的作用及机制研究[J].中草药,2021,52(1):152-159.
-
[11] 李银蕊,吕鸿,彭芳,等.美洲大蠊多肽PAE2逆转肝癌多药耐药性[J].中国实验方剂学杂志,2021,27(5):52-61.
-
[12] 李奇娟,王战国,刘巧,等.美洲大蠊研究现状及其研究中关键问题分析与展望[J].中国中药杂志,2018,43(7):1507-1516.
-
[13] Hilvo M,Denkert C,Lehtinen L,et al.Novel theranostic opportunities offered by characterization of altered membrane lipid metabolism in breast cancer progression[J].Cancer Res,2011,71(9):3236-3245.
-
[14] Wright HJ,Hou J,Xu BZ,et al.CDCP1 drives triple-negative breast cancer metastasis through reduction of lipid-droplet abundance and stimulation of fatty acid oxidation[J].Proc Natl Acad Sci U S A,2017,114(32):E6556-E6565.
-
[15] Guillaumond F,Bidaut G,Ouaissi M,et al.Cholesterol uptake disruption,in association with chemotherapy,is a promising combined metabolic therapy for pancreatic adenocarcinoma[J].Proc Natl Acad Sci U S A,2015,112(8):2473-2478.
-
[16] Hayward D,Cole PA.LSD1 histone demethylase assays and inhibition[J].Methods Enzymol,2016,573:261-278.
-
[17] Menendez JA,Lupu R.Fatty acid synthase and the lipogenic phenotype in cancer pathogenesis[J].Nat Rev Cancer,2007,7(10):763-777.
-
[18] Wang H,Zhang YJ,Lu YN,et al.The role of stearoyl-coenzyme A desaturase 1 in clear cell renal cell carcinoma[J].Tumour Biol,2016,37(1):479-489.
-
摘要
目的:探讨中药蜚蠊改善氟尿嘧啶对错配修复基因缺失(dMMR)肠癌细胞敏感性的相关机制。方法:选择dMMR肠癌细胞,予以不同浓度氟尿嘧啶和蜚蠊作用细胞后,利用MTT法检测两药联合抑瘤性,根据抑制率计算出CI值明确联合增效作用,应用二代基因测序及脂质代谢分析,挖掘出差异代谢基因,数据库分析差异基因与相关机制通路。结果:中药蜚蠊可以改善氟尿嘧啶在HCT116和DLD1肠癌细胞中的疗效,GO功能富集分析和KEGG分析结果显示脂质代谢、自噬调控和凋亡通路发生主要改变,利用LC/MS进行脂质组学检测,共有153个脂质分子发生变化,包括脂肪类、鞘脂代谢物、磷脂代谢物和甘油酯。结论:蜚蠊与氟尿嘧啶联合用于dMMR肠癌细胞具有协同增效作用,可能通过调控代谢通路、自噬及凋亡通路机制改善药物疗效。
Abstract
Objective To explore the mechanisms by which the Chinese medicine Cockroach improves the sensitivity of fluorouracil to dMMR colorectal cancer cells. Methods After selecting the mismatch repair gene-deficient colorectal cancer cells. The combined anti-tumor effects of these two drugs were assessed using the MTT method. The combination index was calculated based on the inhibition rate to determine the synergistic effect. The second-generation gene sequencing and lipid metabolism analysis were employed to identify differential metabolic genes, and database analysis was conducted to understand the pathways associated with differential genes. Results The cockroach was found to enhance the efficacy of 5-FU in HCT116 and DLD1 cells. Results from GO functional enrichment analysis and KEGG analysis showed significant alterations in lipid metabolism, autophagy regulation, and apoptosis pathways. Further lipidomics analysis using LC/MS revealed statistically significant changes in a total of 153 lipid molecules, including lipids, sphingolipid metabolites, phospholipid metabolites, and glycerides. Conclusion The combination of cockroach and 5-FU demonstrates a synergistic enhancement of efficacy against dMMR colorectal cancer cells. This effect is likely achieved by modulating metabolic pathways, autophagy, and apoptosis mechanisms. It provides a theoretical basis for the clinical use of fluorouracil in the treatment of dMMR colorectal cancer patients.
Keywords
Colorectal cancer ; mismatch repair gene ; fluorouracil ; cockroach ; lipid metabolism